重新开放和再生:外泌体涂层支架愈合血管损伤,修复受损组织
立即发布
北卡罗莱纳州立大学的研究人员开发了一种外泌体涂层支架,该支架具有“智能释放”触发器,既可以防止重新开放的血管变窄,又可以向缺血或缺血型的组织提供再生干细胞来源的治疗。
血管成形术是一种打开阻塞动脉的手术,通常需要放置金属支架来加固动脉壁,防止堵塞消除后动脉壁坍塌。然而,支架的放置通常会对血管壁造成一些损伤,刺激平滑肌细胞增殖并迁移到该部位,试图修复损伤。其结果是血管再狭窄:以前通过血管成形术打开的血管再次狭窄。
“支架引起的炎症反应会降低它们的益处,”该研究的通讯作者Ke Cheng说。“理想情况下,如果我们能阻止平滑肌细胞过度反应和增殖,但招募内皮细胞覆盖支架,就能减轻炎症反应,防止再狭窄。”程教授是北卡罗来纳大学再生医学兰德尔·b·特里特聘教授,也是北卡罗来纳大学/北卡罗来纳大学-教堂山联合生物医学工程系的教授。
目前正在使用的药物洗脱支架上涂有抑制细胞增殖的药物,但这些抗增殖药物也推迟了内皮细胞对支架的覆盖,而内皮细胞是医疗保健提供者希望覆盖支架的细胞。
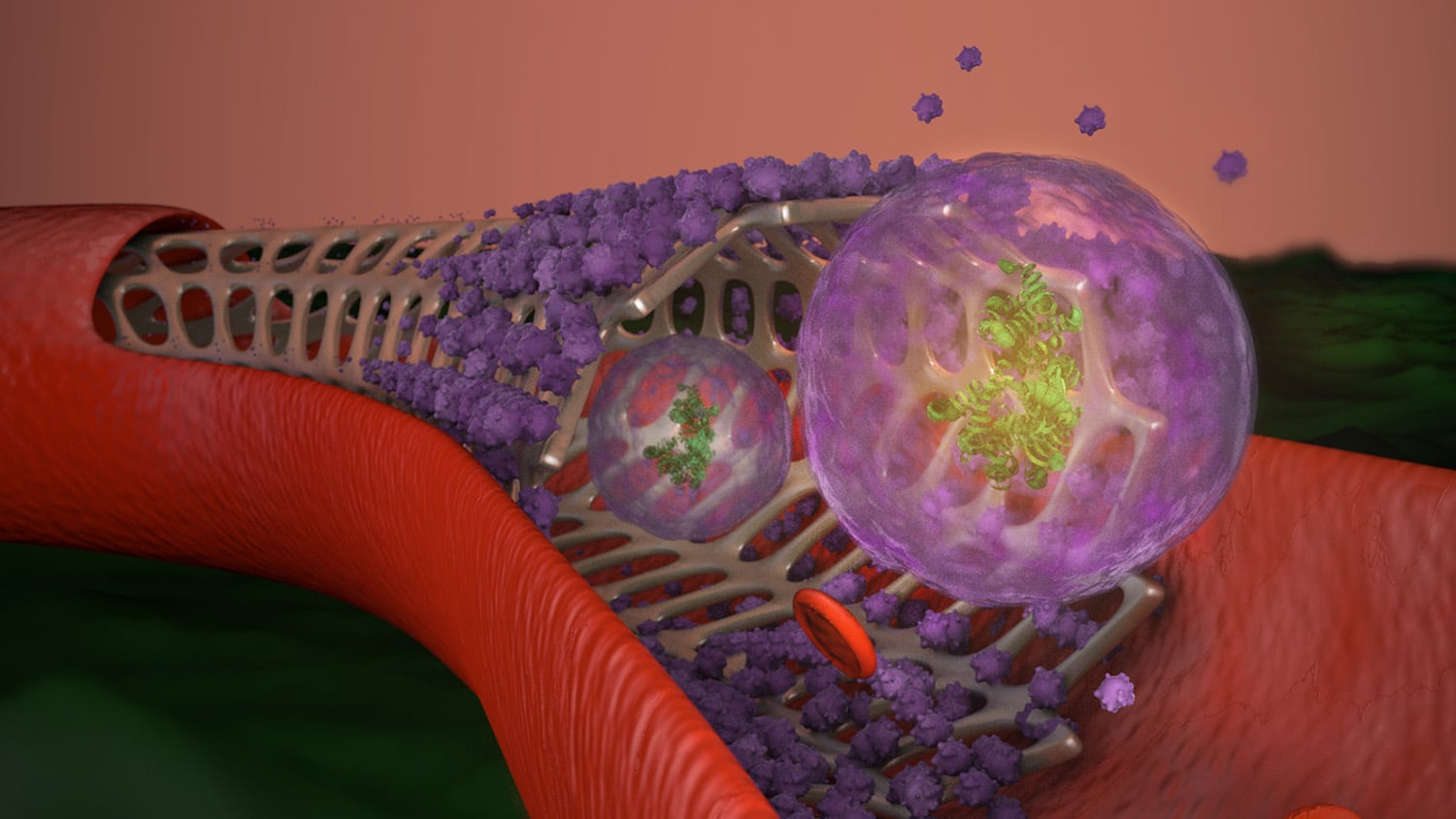
为了解决这个问题,Cheng和他的团队开发了一种由间充质干细胞衍生的外泌体组成的支架涂层。外泌体是大多数细胞类型分泌的微小纳米囊。涂层背后的想法是双重的:首先,由于外泌体由与细胞膜没有多大区别的材料组成,它们“伪装”了支架,以欺骗平滑肌细胞和身体的免疫系统。其次,外泌体促进内皮细胞对支架的覆盖,在损伤的情况下,外泌体可以向下游到达支架部位,促进组织修复。
为了防止治疗的过早耗尽,当支架遇到活性氧(ROS)时释放外泌体——这在炎症反应中更为普遍。
Cheng说:“可以把它看作是外泌体的智能释放功能。”“缺血再灌注损伤发生在血流减少然后重新恢复时,会产生大量ROS。假设心脏因缺血而受损。增强的ROS将触发支架上的外泌体释放,再生疗法将通过血管到达损伤部位。”
研究团队进行了体外试验,以确保生物相容性,并测试释放机制。他们发现,在ROS存在的情况下,外泌体在损伤后48小时内释放了高达60%的分泌物。
在大鼠缺血损伤模型中,研究人员将他们的外泌体洗脱支架(EES)与裸金属支架(BMS)和药物洗脱支架(DES)进行了比较。他们发现,与BMS相比,他们的支架在减少狭窄和促进内皮覆盖方面表现更好。虽然DES在防止再狭窄方面与EES相似,但EES对血管壁的伤害更小,整体内皮覆盖更好。此外,EES释放的外泌体促进了后肢缺血大鼠的肌肉再生。研究人员计划在大型动物模型上测试这种支架,并着眼于最终的临床试验。
Cheng说:“这种生物活性支架促进血管愈合和缺血修复,患者在支架就位后不需要额外的再生治疗程序。”“支架是外泌体的完美载体,外泌体使支架在组织修复中更安全、更有效。”
这项研究发表在自然生物医学工程由美国国立卫生研究院和美国心脏协会支持。北卡州立大学博士后胡士奇、李振华为共同第一作者。
皮克-
编辑:一个抽象的。
外泌体洗脱支架用于缺血损伤后血管愈合
DOI:10.1038 / s41551 - 021 - 00705 - 0
作者:胡士奇,李振华,沈德良,朱大怀,黄柯,苏腾,dinuong - uyen, Jhon Cores, Cheng Ke,北卡罗莱纳州立大学
发表2021年4月5日自然生物医学工程
文摘:
缺血损伤后植入药物洗脱支架可减少内皮细胞和血管平滑肌细胞的增殖,从而抑制新生内膜增生。然而,洗脱的药物也会减慢再内皮化过程,延迟动脉愈合,并可能增加晚期再狭窄的风险。我们发现,在活性氧存在的情况下,支架释放由间充质干细胞衍生的外泌体,可增强大鼠肾缺血-再灌注损伤的血管愈合,促进内皮细胞管的形成和增殖,并损害平滑肌细胞的迁移。与药物洗脱支架和裸金属支架相比,外泌体涂层支架在植入后28天加速了再内皮化,减少了支架内再狭窄。我们还发现,植入单侧后肢缺血大鼠腹主动脉的外分泌体洗脱支架可调节巨噬细胞极化,减少局部血管和全身炎症,并促进肌肉组织修复。
- 类别: